Ivermectin은 1975년에 발견되어 1981년에 수의학 의약품으로 처음 판매되었습니다. 1980년대 후반에 인간에게 적용되었습니다. William Campbell과 Satoshi Ōmura는 이 발견과 적용으로 2015년 노벨 생리의학상을 수상했습니다. 이 약물은 세계 보건에 있습니다. 조직의 필수 의약품 목록이며 미국 식품의약국(FDA)에서 구충제로 승인했습니다. 2018년에 이버멕틴은 10만 개 이상의 처방이 있는 미국에서 420번째로 가장 많이 처방되는 약물이었습니다. 제네릭 의약품으로 이용 가능합니다.

SARS-CoV-2에 대한 이버멕틴의 작용 기전 - 광범위한 검토
여러 약물이 만족스럽지 못한 뒷받침 데이터로 COVID-19 치료에 대한 긴급 사용 승인을 받았지만, 반면에 이버멕틴은 제외되었습니다. 그럼에도 불구하고 많은 국가에서 이버멕틴을 COVID-19의 1차 치료 옵션 중 하나로 채택했습니다.
전 세계적으로 진행 중인 백신 출시 프로그램이 한창 진행 중인 가운데 이러한 백신이 제공하는 면역의 수명이나 새로운 돌연변이 균주에 대한 보호 기능을 제공하는 역할에 대해서는 여전히 논쟁의 여지가 있습니다. 따라서 새롭고 효과적인 항바이러스제에 대한 검색이 계속됩니다.
사망률 감소, 중환자실 입원 및/또는 입원 기간 단축, 이버멕틴 사용으로 바이러스 제거와 같은 결과를 평가하기 위한 의사 주도 임상 시험 프로토콜이 US ClinicalTrials.gov에 등록되었습니다. [7]. 이버멕틴을 사용한 대조 임상 시험은 미국 국립 보건원(ACTIV-6)[ClinicalTrials.gov Identifier: NCT04885530]과 영국(PRINCIPLE)에서 실시하는 1건을 포함하여 진행 중입니다. [ISRCTN 등록: ISRCTN86534580] [ 8, 9].
Ivermectin은 빠른 경구 흡수, 높은 지용성, 체내에 널리 분포되어 간에서 대사되고(cytochrome P450 시스템), 거의 전적으로 대변으로 배설됩니다[4]. 건강한 사람의 표준 경구 투여량에 따르면 3.4-5 h에서 최고 혈장 수준에 도달하고 혈장 반감기는 12-66 h로 보고되었습니다[10]. 널리 사용됨에도 불구하고 인간에서 이버멕틴의 약동학에 대한 연구는 상대적으로 적습니다[11]. Ivermectin은 건강한 피험자(93.2%)에서 혈장 단백질에 강력하게 결합합니다[12]. 이러한 "강력한 결합"은 영양실조와 저알부민혈증이 흔한 국가에서 투여될 때 유익할 수 있으며, 이로 인해 이버멕틴의 "유리 분획"의 가용성이 증가합니다[4]. 저알부민혈증은 COVID-19 환자에서 자주 발견되며 폐 손상의 중증도와도 관련이 있는 것으로 보입니다[13]. 따라서 이버멕틴은 이러한 환경에서 사용될 때 충분한 생체이용률을 가질 수 있습니다.
이 기사는 수년간 이용 가능한 문헌을 기반으로 COVID-19에서 이버멕틴의 역할을 보여주는 시험관 내 및 생체 내 증거를 요약하여 가능한 작용 메커니즘을 논의하는 것을 목표로 합니다(표 1). COVID-19 발병 기전 및 합병증 예방에서 이버멕틴, 숙주 세포 및 SARS-CoV-2 간의 주요 세포 및 생체 분자 상호 작용의 개략도가 제안되었습니다(그림 1).
표 1 SARS-CoV-2에 대한 ivermectin(IVM)의 가능한 메커니즘을 보여주는 연구 목록

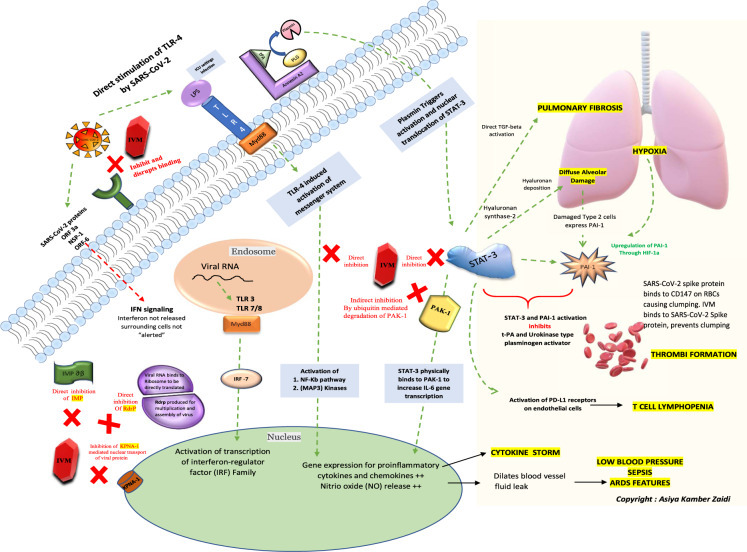
COVID-19 병인 및 합병증 예방에서 ivermectin, 호스트 세포 및 SARS-CoV-2 사이의 주요 세포 및 생체 분자 상호 작용의 회로도: ivermectin (IVM) (적색 블록) ACE-2 수용체 (녹색)에서 SARS-CoV-2 S 단백질의 결합을 억제하고 방해합니다. 녹색 점선은 활성화 경로를 묘사하고 빨간색 점선은 억제 경로를 묘사합니다. TLR4 수용체는 SARS-CoV-2에 의해 직접 활성화되며 또한 LPS 매개 활성화(ICU 설정 중에 본)에 의해 직접 활성화되어 NF-Kb 통로및 MAP3 키나아제의 활성화를 유발하여 염증성 사이토카인 및 케모킨(사이토카인 폭풍에 대한 책임) 및 NO 방출(혈액혈관 팽창, 누출, 유체 압압에 대한 책임)에 대한 핵 내 유전자 발현을 유발합니다. NF-Kb 및 STAT-3 통로 활성화는 COVID-19의 병자 및 후유증의 중심입니다. STAT-3은 PAK1에 물리적으로 결합하고 IL-6 전사를 증가시킵니다. 세포 표면의 부속서 A2는 플라스미노겐을 변환합니다. T-PA의 존재 하에 플라스민에 PLG. 플라스민은 STAT-3의 활성화 및 핵 전좌를 트리거합니다. STAT-3의 강화 조절은 폐세포에서 히알루로난 신타제 2를 자극하여 폐포 손상및 저산소증을 확산시키는 히알루로난 증착을 유발합니다. STAT-3또한 직접 TGF 베타 폐 섬유증을 활성화; SARS-CoV-2 폐 병리학의 전형적인 특성. 손상된 타입 2 세포는 PAI-1을 발현하고 이미 저산소 상태는 STAT-3에 의한 직접적인 자극과 더불어 PAI (저산소 유도인성 인자-1을 통해)의 강화 조절을 유발합니다. 동시 STAT-3 및 PAI-1 활성화는 트롬비 형성으로 이어지는 t-PA 및 우로키나제 형 플라스미노겐 활성제를 억제한다. 또한 SARS-CoV-2 스파이크 단백질은 적혈구에 CD147에 결합하여 응집을 일으킵니다. IVM은 차례로 SARS-CoV-2 스파이크 단백질에 결합하고 따라서 응집을 방지합니다. COVID-19의 T 세포 림프파는 또한 STAT-3에 의한 내피 세포에 PD-L1 수용체의 직접적인 활성화에 기인할 수 있다. IVM은 NF-kb 통로를 직접 억제하고 STAT-3을 억제하고, 유비퀴틴 매개 분해를 증가시킴으로써 PAK1을 간접적으로 억제한다. 세포의 자연적인 항바이러스 반응은 인터페론 조절 유전자및 바이러스 RNA 중재된 TLR-3 및 TLR7/8-Myd88 의 인터페론 레귤레이터(IRF) 제품군의 전사 활성화를 통해서이다. 바이러스가 감염을 확립하기 위해, 이 항바이러스 반응은 인터페론 생산을 차단하여 억제될 필요가 있습니다. 수입 및 KPNA와 같은 단백질은 바이러스 성 단백질및 후속 IFN 신호의 핵 수송을 중재합니다. SARS-CoV-2 단백질(ORF3a, NSP1 및 ORF6)은 IFN 신호를 직접 차단하여 주변 세포가 감염의 의심하지 않는 희생자가 됩니다. IVM은 천연 항바이러스 IFN 방출을 유발하는 KPNA1 수용체(brown)뿐만 아니라 수입복(green)을 모두 억제한다. IVM은 또한 바이러스 성 RdrP를 억제, 바이러스 성 복제에 대 한 책임. ACE-2 혈관신생-변환 효소 2, LPS 리포폴리사카라이드, TLR 톨 유사 수용체, t-PA 티슈-플라스미노겐 활성제, PLG 플라스미노겐, IMPab 수입 알파 베타, Rdrp RNA 종량제 RNA 폴리머라제, KPNA1 카요페린 서브유닛 알파 1, NF-kB 핵인자 카파-라이트-체인 증강 활성 B 세포, Map3 키나아제 미토겐 활성화 키나아제, PAK1 P21 활성화 키나아제 1, STAT-3 신호 트랜스듀서 및 활성제 3, PAIgen-1 HIF-1 저산소유발인자
결과
안티헬름인으로 이베르멕틴
이베르멕틴은 항헬만딕인[14]로승인되었습니다. 선충과 곤충에서 발견되는 글루타민염식 에서 선택적 양성 알로스터 변조기이며, 염화물 이온 유입을 유발하는 염화물 이온 유입으로 이어지는 이러한 채널에 결합하여 작용하여 세포의 과잉 편광을 유발하므로 기능 장애[15]. 그러나, 높은 농도에서, ivermectin 또한 GABA 수용 체를 호스트에 바인딩할 수 있습니다 만 혈액-뇌 장벽 (BBB) "새는." 이는 P-당단백질 약물 펌프(MDR-1)에 의해 약물이 "제외"되기 때문에 BBB를 가진 건강한 인간에게 는 그렇지 않다. 챈들러 외. ivermectin 잠재적인 신경 학적 불리 한 약물 반응의 무료 간주, 과다 복용의 상황을 제외 하 고[16].
SARS-CoV-2 바이러스 구조
SARS-CoV-2는 SARS-CoV와 구조적 유사성을 가진 sarbecovirus입니다. SARS-CoV-2 베타 코로나바이러스의 4가지 구조 단백질 중, 즉 스파이크(S) 단백질, 막(M) 단백질, 봉투(E) 단백질 및 뉴클레오캡시드(N) 단백질, S 단백질은 강력한 중화 항체 반응을 유도하는 데 책임이 있다. 호스트 세포내SARS-CoV-2의 진입은 숙주 세포 표면에 존재하는 안지오텐신 변환 효소 2(ACE-2) 수용체에 대한 S단백질(수용체 결합 도메인)의 S1 서브유닛의 결합에 의해 중재된다[17]. S2 서브유닛은 연장막 프로테아제, 세린 2(TMPRSS2)로 프라이밍 후 세포막과 결합하는 융합 단백질과 연관되며 숙주 세포와의 융합을 담당한다.
SARS-CoV-2 게놈은 ~29.8 kb 뉴클레오티드로 구성됩니다. 14개의 오픈 판독 프레임(ORF)을 가지고 있으며 27개의 단백질을 인코딩[18]. 바이러스 게놈의 5′ 2/3는 복제 유전자를 인코딩합니다. ORF1a와 ORF1b : 그것은 두 개의 ORFs를 포함합니다. ORF1a/b는 폴리머라제 프레임 변속에 의해 두 개의 다단백질을 인코딩; 이들은 그 때 15비구조적인 단백질 (nsps) : nsp1-10 및 nsp12-16로 번역후 갈라져 있습니다. 나머지 게놈은 4개의 구조 단백질을 위해 인코딩[(S 단백질, E 단백질, M 단백질, N 단백질], 8개의 부속 단백질(3a/3b, p6, 7a/7b, 8b, 9b 및 ORF14)[18]. 복제본은 또한 파통과 같은 프로테아제(PLpro)와 세린형 프로테아제 또는 주 프로테아제(Mpro)[19]를인코딩합니다.
원칙적으로, 분자는 항 바이러스 약물로 작동할 수 있습니다 그것은 경우 "바이러스 복제 주기의 일부 단계를 억제, 신체의 세포에 너무 독성 없이." [20]
항 바이러스 제의 행동의 가능한 모드는 다음과 같습니다.
(1)세포 외 바이러스 입자를 비활성화합니다.
(2)바이러스 부착 및/또는 항목을 방지합니다.
(3)바이러스 게놈의 복제를 방지합니다.
(4)특정 바이러스 성 단백질의 합성을 방지 합니다.
(5)새로운 전염성 비리의 조립 또는 방출을 방지합니다.
SARS-CoV-2 바이러스에 대한 ivermectin의 역할
ivermectin의 활동의 목표는 다음 네 그룹으로 나눌 수 있습니다:
A. SARS-CoV-2에 대한 직접 조치
레벨 1: SARS-CoV-2 셀 항목에 대한 조치.
레벨 2: 수입 (IMP) 슈퍼 패밀리에 대한 조치.
레벨 3: 이오노포레로서의 행동.
B. 바이러스 복제에 중요한 호스트 대상에 대한 조치
레벨 4: 항 바이러스로서의 행동.
레벨 5: 바이러스 복제 및 어셈블리에 대한 작업입니다.
레벨 6: 바이러스 성 다단백질의 번역 후 처리에 대한 조치.
레벨 7: 카요페린(KPNA/KPNB) 수용체에 대한 조치.
C. 염증에 중요한 호스트 표적에 대한 조치
레벨 8: 인터페론(INF) 레벨에 대한 조치입니다.
레벨 9: 통행료 와 같은 수용 체에 행동 (TR).
레벨 10: 핵 계수-θB(NF-θB) 경로에 대한 조치.
레벨 11: COVID-19 sequalae에 관여할 수 있는 JAK-STAT 통로, PAI-1에 대한 조치.
레벨 12: P21 활성화 키나아제 1(PAK1)에 대한 조치.
레벨 13: 인터류인-6(IL-6) 레벨에 대한 조치.
레벨 14: P2X4 수용체의 알로스터액 변조에 대한 조치.
레벨 15: 높은 이동성 그룹 상자 1 (HMGB1)에 대한 조치.
레벨 16: 폐 조직 및 olfaction에 면역 조절기로 작용합니다.
레벨 17: 항염증제로서의 작용.
D. 다른 호스트 대상에 대한 조치
레벨 18: 플라스민과 별관 A2에 대한 조치.
레벨 19: 적혈구(RBC)의 CD 147에 대한 작용.
레벨 20: 심장 기능에 저산소증하에서 미토콘드리아 ATP에 작용.
직접적인 "항 바이러스 표적"은 항 염증 표적이 질병의 후반 단계에서 해결될 수 있는 동안 초기 단계에서 유용할 수 있습니다.
SARS-CoV-2에 이버멕틴의 직접 작용
레벨 1: SARS-CoV-2 셀 항목에 대한 조치
Lehrer 외.에 의한 연구는 이베르멕틴이 호스트 세포내내의 진입을 차단하는 호스트 세포 ACE-2 수용체의 SARS-CoV-2 스파이크 단백질 및 히스티딘 378의 류신(91)의 영역에 도킹된 것을 관찰했다[21]. Eweas 외.에 의해 또 다른 연구에서, 아이버멕틴, 클로로퀸, 하이드록시 클로로퀸, 렘데시비르 및 파비피라비르와 같은 잠재적용도 약물은 S및 M 단백질, RNA 의존 RNA 폴리머라제(RdRp), 핵단백질, 핵단백질을 포함한 다양한 SARS-CoV-2 표적 단백질로 선별 및 분자 도킹을 수행했다. Ivermectin은 다음과 같은 5 가지 중요한 도킹 속성을 보여 주었다 [22]:
(1)
S 당단백질(Moldock 점수 -140.584) 및 단백질-리간드 상호작용(Moldock score-139.371)의 예측된 활성 부위에 대한 가장 높은 결합 선호도.
(2)
SARS-CoV-2 RdRp 단백질(Moldock score -149.9900) 및 단백질 리간드 상호작용(Moldock score -147.608)의 예측된 활성 부위에 상당한 결합 친화성을 형성하여 Cys622 및 Asp760이라는 두 가지 아미노산만으로 H-유대를 형성했습니다.
(3)
nsp14의 예측 활성 부위에 가장 높은 결합 친화성 (몰독 점수 -212.265)
(4)
TMPRSS2 단백질(Moldock 점수 -174.971) 및 단백질 리간드 상호작용(Moldock score -180.548)의 활성 부위에 대한 가장 높은 결합 친화성. 더욱이, TMPRSS 단백질의 예측 활성 부위에 존재하는 Cys297, Glu299, Gln438, Gly462 및 Gly464 아미노산 잔류물을 가진 5개의 H-결합을 형성했습니다.
(5)
스파이크 단백질(open)의 자유 결합 에너지는 렘데시비르(-232.973 kJ/mol)보다 이베르멕틴(-398.536 kJ/mol)에서 더 높았다.
Choudhury 등에서 실시한 실리코 데이터 분석에 따르면 아이버멕틴은 결합을 방해하여 "항바이러스 효율"을 실행하기 위한 가장 가능한 대상으로 바이러스 스파이크 단백질, 주요 프로테아제, 복제본 및 인간 TMPRSS2 수용체를 효율적으로 활용한다는 것을 입증했습니다. ivermectin 모두에서 단백질 목표를 악용 하기 때문에, 바이러스와 인간, 이것은 SARS-CoV-2에 대 한 그것의 우수한 체 외 활동에 대 한 책임 있을 수있습니다.[23].
SARS-CoV-2에 대한 백신의 개발은 스파이크 단백질 생물학 (바이러스 표적)을 중심으로 하고 최근에 문서화 된 "백신 탈출 균주"는 걱정의 원인이되었습니다. 이러한 상황에서, ivermectin은 둘 다, 바이러스뿐만 아니라 호스트 표적으로 하고 따라서 백신에 의해 제안된 면역을 "탈출"할 수 있는 이 새로운 긴장에 대하여 잠재적인 치료역할을 할 수 있었습니다.
레벨 2: IMP 슈퍼 패밀리에 대한 조치
세포 내부, 핵안팎으로 단백질의 핵 수송은 신호 의존과 α 및 β 형태로 존재하는 단백질의 IMP 슈퍼 패밀리에 의해 중재된다. 이러한 IMPα/β1은 IMPα에 의한 "화물 인식"에 IMP β1에 결합하는 IMP α 위에 존재하는 "IBB" (IMP β 결합) 부위를 가진 이종수로서 존재한다. 호스트 세포 항목 시 SARS-CoV-2 바이러스는 핵 모공 복합체를 통해 핵을 입력하기 위해 숙주 단백질 IMP α/β1 이성구(IMP)를 통해 단백질을 "로드"하는 경향이 있다. 일단 내부, IMP 분자 SARS-CoV-2 바이러스에서 바이러스 단백질 호스트 세포 기계를 납치 하 고 INF의 방출을 차단 하 여 자연 세포 "항 바이러스" 반응을 억제 하는 동안 분리 (지속적인 바이러스 공격의 주변 세포를 경고 하는 감염 된 세포에 의해 발표 된 항 바이러스 물질). 그 결과, 주변 세포는 바이러스의 "의심하지 않는 피해자"가 되고 감염은 면역 세포에 의한 인식을 탈출하는 바이러스로 계속[24]. 이버멕틴은 바이러스 감염이 있는 상황에서 IMP α/β1 이종수의 IMPα 성분을 표적으로 하여 IMP β1과의 상호작용을 방지하고 바이러스 성 단백질의 핵 수송을 차단한다. 이를 통해 세포는 정상적인 항바이러스 반응을 수행할 수 있습니다[25]. 이러한 경우, 여기서 ivermectin의 활성은 진동, 즉 동일한 수용체에 대해 경쟁하여 바이러스를 중화한다는 점에 유의해야 한다.
레벨 3: 이오노포레로서의 행동
이오노포레스는 전형적으로 하나 이상의 이온(보통 양이온)에 대한 특정 결합 부위를 구성하는 친성 포켓을 갖는 분자이며, 외부 표면은 소수성이며, 따라서 형성된 복합체가 세포막을 교차하여 수력 전해질 균형에 영향을미친다[26]. "헤드 테일" 모드에서 서로 반응하는 두 개의 아이버멕틴 분자가 그러한 것으로 간주되기에 적합한 복합체를 만들 수 있다고 가설이 될 수 있다[27]. 이 ionophores는 호스트 세포를 부착하고 그밖 바이러스성 입자의 생산을 위한 그들의 생화확적인 기계를 이용하기 위하여 그것을 입력하기 전에 감염의 초기 단계에서 바이러스를 중화하는 것을 허용합니다. Ivermectin은 염화물 채널 업 조절에 의해 요오노포어로서 작용하여 세포 멸망및 삼투세포 사멸을 일으킨다[28, 29].
바이러스 복제에 대한 호스트 대상에 대한 조치
레벨 4: 항 바이러스로서의 행동
Heidary 외에 의해 체계적인 검토 기사. 지카 바이러스, 뎅기열 바이러스, 황열병 바이러스, 웨스트 나일 바이러스, 헨드라 바이러스, 뉴캐슬 바이러스, 베네수엘라 말 뇌염 바이러스 (VEEV), 치쿤구냐 바이러스, 셈리키 포레스트 바이러스 및 신비디스 바이러스, 조류 바이러스, 신비크 바이러스, 조류 바이러스, 조류 바이러스, 신비디스 바이러스, 조류 바이러스, 신비크 바이러스, 조류 바이러스, 조류 바이러스, 조류 바이러스, 신비증 바이러스, 조류 바이러스, 조류 바이러스, 신비비 바이러스 와 같은 RNA 바이러스를 포함한 다른 바이러스에 대해 이버멕틴의 "항바이러스"특성에 대해 논의했습니다. 인간 면역결핍 바이러스 유형 1뿐만 아니라 말 헤르페스 바이러스 유형 1, BK 폴리종 바이러스 (BKPyV), 돼지 순환 바이러스 2 (PCV2), 소 헤르페스 바이러스 1 바이러스 (BoHV-1) 및 의사 랍 바이러스[30]와같은 DNA 바이러스. Ivermectin은 IMP α/β 수송기와의 비구조적 단백질 5 상호 작용, 감소된 핵 관련 캡시드, 바이러스 타이터 및 VEEV 감염 세포에서 캡시드 단백질의 핵 축적 이외에 VEEV에 의한 세포요법 효과를 차단함으로써 DENV의 증식을 억제하였다[30]. Wagstaff 외.에 의한 체외 연구에서 연구자들은 HIV-1 핵 단백질 전달의 억제제로서 ivermectin의 효과를 평가했습니다. 연구 결과는 ivermectin이 IMPα/β 통해 핵 수송 억제제이다는 결론을 내렸습니다, 그러나 IMPβ1을 통해서만 핵 전송에 영향을 미치지 않으며, 사전 통합 복합체의 중요한 성분으로서 HIV-1의 활성 내테그라 단백질의 핵 수입을 완전히 억제한다[31]. 더욱이, ivermectin은 핵 입력의 억제로 인한 바이러스 유전자 발현의 감소를 주도, (BKPyV), 활성 핵 모공 복합 전달을 통해 핵에 대한 액세스 권한을 가지고 있음을 나타내는[32]. Ivermectin은 PCV2에 대한 BoHV-1 및 핵 국소화 신호(NLS)-매개 핵 수입 경로에 대한 용량 의존적 방식으로 IMP α/β 의존적인 핵 전송 억제 및 감소된 바이러스 복제를 시연하였다[33].
레벨 5: 바이러스 복제 및 어셈블리에 대한 조치
Caly et al.에 의한 체외 연구는 SARS-CoV-2 바이러스에 감염된 베로/hSLAM 세포가 5 μM ivermectin에 "노출"할 때 대조군과 비교했을 때 48h에서 바이러스 RNA의 5000배 감소를 보였다는 것을입증하였다[34]. 이 연구는 일상적인 복용량을 통해 COVID-19의 치료 효과를 달성 하기 위해 ivermectin의 무 능력에 관한 의견을 끌었다. 이와는 달리, Arshad 등은 모델링 접근법을 활용하여 EC50보다 10배 이상 높은 이버멕틴의 폐 축적을 예측했다. ivermectin의 높은 폐 조직 농도의 달성의 이 가능성은 특히 호흡기 감염을 위한 추가 연구를 위한 문을 열어 둡니다[35].
Caly 외.에 의한 연구에 대한 설명은 검토 기사에서 제공되었습니다: COVID-19의 ivermectin의 임상 연구의 글로벌 동향은 오무라 사토시 교수가 공동 저술한 "체외 실험 시스템에 대한 감도 설정"에 관한 것입니다. 저자에 따라, Vero/hSLAM 세포를 사용하여, 시험 약물의 항바이러스 활성을 안정적으로 측정하고 IC50 = 2 μM의 감도는 거짓 긍정이나 거짓 네거티브가 발생하지 않았기 때문에 적절했다. 따라서, Caly 외.에 의한 연구는 단지 ivermectin이 시험관 내에서 반 SARS-CoV-2 활동이 있다는 것을 것을을 나타냈다- 더 이상, 더 적은. 또한, 생체 외 실험에서 임상 연구에 연결하는 데 사용할 수 있는 생체 내 감염 실험이 있다는 사실[36].
Swargiary 외에 의한 실리코 연구의 또 다른 것은 바이러스 복제의 억제를 건의하는 ivermectin과 RdRp 사이의 -9.7 kcal/mol의 최고의 결합 상호 작용을 시연[37]. nsp12에 거주하는 RdRP는 코로나바이러스 복제 및 전사 복합체의 중심이며 바이러스 게놈의 복제를 위한 바이러스 수명 주기에서 중요한 효소이기 때문에 유망한 약물 표적으로 제안되고 있으며 또한 피게놈 mRNAs의 전사를 위한것이다[38]. 이버멕틴은 바이러스 형 Rdrp에 바인딩하고 그것을 방해. nsp14에 ivermectin의 매우 효율적인 바인딩은 바이러스 복제 및 조립을 억제하는 역할을 확인합니다. nsp14는 전사 및 복제에 필수적이라는 것은 잘 알려져 있습니다. 그것은 교정 엑소리보넥리스역할을 하며 메틸 트랜스퍼라제 활성[39]에의해 바이러스 RNA 캡핑에 역할을 한다. 더욱이, 바이러스 성 N 인단 단백질 및 M 단백질에 ivermectin의 고효율 결합은 바이러스 복제 및 조립을 억제하는 역할을 암시 [22].
레벨 6: 바이러스 성 다단백질의 번역 후 처리에 대한 조치
일단 호스트 세포로 입력을 얻고, 바이러스성 RNA는 큰 "다단백"으로 호스트 리보솜에 의해 번역됩니다. 일부 효소는 이 다단백에서 자가염을 통해 분리하고 다른 단백질이 분리하고 복제를 위한 그들의 기능을 실행하는 것을 더 돕습니다. 이러한 효소 중 하나, 3 chymotrypsin 같은 proteases (3′cl 프로/Mpro) 다른 단백질을 일으키는 원인이 되는 이 다단단백질에 작동에 대 한 책임 "librate" 그리고 바이러스 성 복제를 수행. 이버멕틴은 이 효소에 결합하여 그것을 방해[40]. 그것은 또한 효율적으로 단백질에 결합, Mpro, 그리고 SARS-CoV-2의 PLpro에 더 적은 정도; 따라서 바이러스 다단백질의 번역 후 처리를 방지하는 역할을한다[22].
레벨 7: 카요페린(KPNA/KPNB) 수용체에 대한 조치
Karyopherin-α1 (KPNA1)은 전사 1 (STAT1)의 신호 변환기 및 활성제의 핵수송에 필수적이며 STAT1과 KPNA1 (STAT1/KPNA1) 사이의 상호 작용은 비고전적 NLS를 포함한다. Ivermectin은 KPNA/KPNB1-바이러스 성 단백질의 핵 수입을 억제하여 세포가 정상적인 항바이러스 반응을 수행 할 수 있도록[34].
염증에 대한 호스트 대상에 대한 조치
레벨 8: INF 수준에서의 작업
바이러스에 감염된 세포는 바이러스 발작을 경고하는 이웃 세포에 존재하는 IFN 수용체에 결합하는 INFs를 방출합니다. IFN-I 및 IFN-III 수용체는 JAK-STAT 제품군의 구성원을 더욱 활성화시합니다. 숙주 세포로 의 입력을 얻은 후 바이러스는 숙주 세포 기계를 납치하고 정상적인 INF 매개 숙주 세포 항 바이러스 반응을 적대하는 방향으로 작동합니다. ORF3a, NSP1 및 ORF6과 같은 SARS-CoV-2 단백질은 IFN-I 신호 신호를 억제[42, 43]. 그 결과, SARS-CoV-2 바이러스 감염 세포를 둘러싼 세포는 "실패"를 수신하여 "중요하고 보호적인 IFN 신호"를 수신하여 이 SARS-CoV-2 바이러스가 어떤 방해 없이 복제되고 퍼지도록 합니다. 이것은 이 단계에서 COVID-19 감염이 임상적으로 "감지하기 어렵다"는 주된 이유 중 하나입니다[44].
Ivermectin은 IFIT1, IFIT2, IF144, ISG20, IRF9 및 OASL과 같은 여러 IFN 관련 유전자의 발현을 촉진하는 것으로 나타났다[45].
레벨 9: TR에 대한 작업
바이러스 항목시, 숙주 세포에 존재하는 세포 내 패턴 인식 수용체 (PRR)는 바이러스 성 공격을 검출할 책임이 있습니다. 바이러스는 TR이라는 하나의 PRR을 활성화합니다. 이 수용체는 병원체를 찾아 묶는 것을 돕는 각종 면역 계통 세포에 나타나있습니다. TR의 활성화는, 올리고머화를 일으켜 INF 규제 요인(IRF) 및 NF-kB 전사 인자를 더욱 활성화하여 INF 생산을 유도[46]. Ivermectin은 NF-kB 통로의 활성화 및 TLR4 신호의 억제의 봉쇄에 있는 역할을 한다[47].
레벨 10: NF-θB 경로에 대한 조치
활성화된 B 세포(NF-θB)의 핵인자 카파-라이트-체인 증강제의 활성화는 사이토카인 및 케모킨을 코딩하는 유전자를 포함하는 다양한 염증 유전자의 발현을 유도한다[48]. Jiang et al.은 세포 독성을 유발하지 않은 매우 낮은 용량의 ivermectin이 전사 인자 NF-θB의 억제에 의해 체외 및 생체 내 화학요법 약물에 대한 종양 세포의 내성을 크게 반전시켰다는 것을 입증하였다[49]. 또한, 장 외는 Ivermectin이 NF-θB 통로를 차단하고 마우스에서 LPS 유도 생존을 개선함으로써 염증성 사이토카인의 리포폴리사카라이드(LPS)유도 된 생산을 억제한다고 제안했다[47]. 따라서, ivermectin를 사용 하 여 세균 감염의 증가 기회가 있는 ICU 설정에 도움이 될 수 있습니다 (LPS 중재).
레벨 11: JAK-STAT 경로, PAI-1 및 COVID-19 sequalae에 대한 조치
SARS-CoV-2 바이러스 부하, 질병 심각도 및 진행 사이에 강한 상관 관계가 존재[50]. COVID-19는 발열, 마른 기침 과 같은 독감과 유사한 증상을 유발할 뿐만 아니라 폐 용기에서 미세 혈관 병증으로 광범위한 혈전증으로 이어질 수 있습니다[51],D-dimer 수준을 상승 [52],원인 림프계 [53], 염증성 사이토카인 및 케모킨 생산[54]뿐만 아니라 상당한 고도의 주요 고도로 이어질 [54] ] SARS-CoV-2는 SARS-CoV와 구조적 유사성을 가중시합니다. 몇몇 SARS-CoV 단백질은 IFNs와 하류 JAK (야누스 키나세)-STAT 신호 경로의 항 바이러스 활동을 적대시합니다. JAK 패밀리 키나아제는 온토게니, 면역력, 만성 염증, 섬유증 및 암에 광범위한 기능을 표시합니다[56].
STAT 및 NF θB의 구성원과 같은 숙주 단백질은 IMPα/β1 이성구에 의해 매개되는 핵 봉투 임베디드 핵 모공을 통해 핵에 진입하고 COVID-19 병인발생에 역할을 한다. Frieman 등은 액세서리 SARS ORF6이 거친 내민성 망상/골지 멤브레인에 핵 수입 계수를 격리하여 STAT1 기능을 적대한다는 것을 입증하였다[57]. 마쓰야마 등의 리뷰 기사는 IFN 및 STAT 1의 SARS-CoV-2 매개 억제를 암시하고, 후속 으로 전환하여 STAT-3 지배적인 신호 네트워크로 전환하여 COVID-19의 거의 모든 임상 적 특징을 초래할 수 있다[44].
더 논의하기 전에 STAT-3 업 규제와 COVID-19 후유사이의 링크와 STAT-3 억제에 있는 ivermectin의 역할을 이해하는 것이 중요합니다. STAT-3은 해로운 COVID-19 캐스케이드를 중재하는 "중앙 허브"역할을 합니다. 폐에서 STAT-3은 히알루로난 신타제 2를 활성화하여 히알루로난의 증착으로 인해 확산폐포 손상을 유발합니다. 손상된 타입 2 폐포 세포는 PAI-1(플라스미노겐 활성제 억제제-1)를 발현한다. 또한, 확산폐포 손상으로 인한 저산소증은 HIF-1a를 통해 PAI-1의 업레충을 유발한다. STAT-3은 또한 PAI-1을 직접 활성화합니다. PAI-1 및 STAT-3의 동시 활성화는 t-PA 및 우로키나아제 형 플라스미노겐 활성제를 억제하여 모세혈관내의 혈전 형성으로 이어진다. PAI-1은 또한 NF-kB 통로를 더욱 활성화하는 대식세포에 TLR4 수용체에 결합합니다.
가혹한 COVID-19의 전형적인 "사이토카인 폭풍"은 대식세포에서 선동적인 사이토카인, TNFα 및 IL-6의 STAT-3 중재된 강화를 관련시킵니다. 또한 STAT-3은 PAI-1 수준을 조절하는 C 반응성 단백질을 유도합니다. STAT-3은 폐 섬유증을 유발하는 TGF-β 증가로 이어지는 IL-6 유전자 전사활성화에 직접적인 책임이 있습니다. 내피 세포에 존재하는 PD-L1 수용체는 Stat-3에 의해 활성화되어 T 세포 림프파를 유발한다. IvermectinCOVID-19 후유증 감소에 도움이 될 수 있는 직접적인 억제를 통해 STAT-3억제[44].
레벨 12: PAK1에 대한 조치
PAK1은 JAK1과 STAT-3 모두에 물리적으로 결합하고, 그 결과 PAK1/STAT-3 복합체는 COVID-19에서 사이토카인 폭풍에 대한 IL-6 유전자 전사를 활성화[58]. Ivermectin은 Akt/mTOR 신호를 억제하고 PAK1의 유비퀴틴 매개 분해를 촉진하여 STAT-3 활성을 손상시키고IL-6 생산을 감소시합니다[59].
레벨 13: IL-6 레벨에 대한 조치
장 외(Zhang et al.)의 연구는 ivermectin이 IL-6 및 TNFα 생산을 억제하고, SARS-CoV-2에 의해 유도된 해로운 사이토카인 폭풍의 두 가지 주요 구성 요소와 "극적으로 감소" IL-6/IL-10 비율 변조 감염 결과[47, 60].
레벨 14: P2X4 수용체의 알로스터액 변조에 대한 조치
P2X 수용체는 양이온을 선택적으로 하는 채널이며, 세포외ATP[61]에의해 게이트되고 건강 및 질병에서 여러 기능을 중재한다[62]. P2X 수용체의 7개 하위 단위에서 P2X4 아이버멕틴에 가장 민감하다. P2X의 양성 알로스터액 변조4 ivermectin에 의해 CXCL5 (프로 염증 케모키네)의 ATP 매개 분비를 향상시킵니다. CXCL5는 상이한 조직에서 염증 세포에서 발현되는 화학성분 분자이며 호중구 화학요법 및 케모신청소[63]를조절한다.
레벨 15: HMGB1에 대한 조치
손상 관련 분자 패턴 HMGB1은 손상된 세포에 의해 방출되어 TLR4 수용체에 대한 고뇌로 작용하여 COVID-19와 관련된 폐 염증을중재한다[64]. 이버멕틴은 HMGB1[65]를억제합니다.
레벨 16: 폐 조직 및 olfaction에 면역 조절기로 작용
De Melo et al.에 의한 연구에서, ivermectin의 효력은 COVID-19를 위한 모형으로 황금 시리아 햄스터를 사용하여 SARS-CoV-2 감염에 조사되었습니다. 남성과 여성 성인 황금 시리아 햄스터 는 SARS-CoV-2의 6 × 104 PFU로 접종되었습니다. 감염 시 동물은 임상 환경에서 고전적으로 사용되는 ivermectin(400 μg/kg의 항 기생충 투여량)의 단일 피하 주사를 받았으며 4일 이상 모니터링하였다. 모의 감염된 동물은 생리적 용액만 받았다. 흥미롭게도, ivermectin는 성 의존적이고 구획화된 면역 조절 효과를 가지고 있어 임상 적퇴를 방지하고 감염된 동물의 후각 적자를 감소시켰습니다. 이 효력은 성 의존했습니다: 감염된 남성은 감염된 여성에서 표시의 완전한 부재가 보인 반면 임상 점수에 있는 감소를 제시했습니다. 후각 성과에 관해서는, 고체증/무증증증으로 제시된 식염수의 83.3%(10/12)는 아이버멕틴 치료 수컷의 33.3%(4/12)와 대조적이다(피셔의 정확한 테스트 p = 0.036). 이버멕틴 치료 여성(0/6)에서는 후각 적자가 관찰되지 않았으며, 식염수 치료 여성의 33.3%(2/6)가 저체증/무산소증(피셔의 정확한 테스트 p = 0.455)으로 나타났다. Ivermectin 극적으로 폐 조직에서 IL-6/IL-10 비율을 감소, 이는 가능성이 치료 동물에서 더 유리한 임상 프리젠 테이션을 차지[60]. 후각의 손실은 COVID-19[66]에서일반적인 증상 중 하나로 보고되었습니다. 흥미롭게도, 인도에 있는 환자의 대다수는 그들의 임상 과정 도중 짧은 빈소 기간 후에 냄새의 그들의 감각을 되찾았습니다. ivermectinSARS-CoV-2 유도 후각 적자를 감소시키는 역할을 할 수 있다는 가설이 있을 수 있습니다.
레벨 17: 항염증제로서의 작용
ivermectin의 항염증 작용을 위한 메커니즘은 LPS에 의한 사이토카인 생산억제, NF-kB의 활성화 봉쇄, 스트레스 활성화 MAP 키나제 JNK 및 p38, TLR4 신호의억제[47, 67]로설명되었다. 더욱이, 면역세포 모집, 기관지알알라 라베액, IgE 및 IgG1 분비물에서 의한 세포사포생성, 혈청의 분비뿐만 아니라 잔세포에 의한 점액의 하이퍼분비도 ivermectin[68]에의해 현저히 감소하였다.
다른 호스트 대상에 대한 조치
레벨 18: 플라스민과 부속서 A2에 대한 조치
자이디 외.에 의한 연구에 따르면, A2 부속서는 COVID-19 병리생리학에 연결될 수있다[69]. 부속서 A2는 t-PA의 존재시 플라스미노겐을 플라스민으로 변환하기 위한 동수용체역할을 한다. 증가 된 플라스민 수준은 comorbid 상태에서 발견되며 바이러스 감염의 초기 단계에 대한 책임이 있습니다. 플라스민은 STAT-3의 직접적인 활성화로 이어지며 해로운 COVID-19 후유증을 유도합니다. Ivermectin 직접 STAT-3억제 하 고 COVID-19 합병증의 억제에 역할을 할 수 있습니다.
레벨 19: RBC의 CD147에 대한 조치
ACE-2와 함께 RBC에 존재하는 막 수용체 CD147은 SARS-CoV-2 스파이크 단백질을 위한 키 결합 부위로 인식되고 있다. SARS-CoV-2는 RBC로 내부화되지 않지만 이러한 첨부 파일은 응집로 이어질 수 있습니다. Ivermectin은 CD147[70]로결합할 수 없게 만드는 바이러스의 S 단백질에 결합합니다. 이 작업은 또한 COVID-19의 고급 단계에서 응고/혈전 현상으로 제시하는 것이 유익할 수 있습니다.
레벨 20: 심장 기능에 저산소증 하에서 미토콘드리아 ATP에 작용
SARS-CoV-2는 장거리 운반기뿐만 아니라 활성 감염에서 심혈관 시스템에 급성 심근 손상 및 만성 손상에 대한 잘 알려진 원인이었다[71]. 나가이 외.는 이버멕틴이 Cox6a2 발현을 유도하여 미토콘드리아 ATP 생산을 증가시키고, 비약학적 인 비대증을 예방하고 심장 기능을 향상시키는 저산소 조건하에서 미토콘드리아 ATP를 유지한다는 것을입증하였다[72].
결론
우리는 SARS-CoV-2 복제 및 질병 COVID-19에 관여할 수 있는 다중 바이러스성 및 호스트 표적의 억제에 간행된 결과를 요약했습니다. SARS-CoV-2 및 COVID-19에서 여러 항 바이러스 및 호스트 표적 활동이 ivermectin에 대해 보고되었지만, 이러한 활동이 질병의 예방 및 치료에 역할을 하는지 여부는 여전히 불분명합니다. 진행 중인 통제된 임상 시험은 이 활동이 임상 효험으로 번역될 지 밝힐 것입니다.
참조
1.가레바기 R, 하이드리 에프 COVID-19, 이란: 손으로 수영! 스위스 메드 Wkly. 2020;150:w20242. https://doi.org/10.4414/smw.2020.20242.
2.크럼프 A, 오무라 S. 이버멕틴, 일본에서 '원더 마약': 인간의 사용 관점. 프롬 Jpn Acad Ser B Phys Biol Sci. 2011;87:13-28. https://doi.org/10.2183/pjab.87.13.
3.키르식 LH, 델 로소 JQ, 레이튼 AM, 샤우버 J. ivermectin와 임상 경험의 25 년 이상: 적응증의 증가에 대 한 안전의 개요. J 약물 피부. 2016;15:325–32.
4.곤잘레스 칸가 A, 외. 인간에서 ivermectin의 약동학 및 상호 작용-미니 검토. AAPS J. 2008;10:42-6. https://doi.org/10.1208/s12248-007-9000-9.
5.쿠마르 BS, 제야라만 M, 자인 R, 아누딥 TC. COVID에 대한 무기고에서 놀라운 약물-19: ivermectin에서 약물 증거. J Adv 메드 메드 레스 2020;32:30-7.
6.Novac N. 약물 재배치의 도전과 기회. 동향 Pharm Sci. 2013;34:267-72.
7.ClinicalTrials.gov [인터넷]. Clinicaltrials.gov. 2021 [인용 11 월 10 11 월 2021]. 에서 사용할 수 : https://clinicaltrials.gov/ct2/home 홈 - ClinicalTrials.gov.
8.Activ6study.org. Activ-6 연구. Activ6study.org; 2021. https://activ6study.org/.
9.Principletrial.org. 원칙 시험에 참여하십시오. Principletrial.org.; 2021. https://www.principletrial.org/.
10.에드워즈 G, 딩스데일 A, 헬스비 N, 오메 ML, 브레켄리지 AM. 캡슐, 태블릿 및 경구 용액으로 투여 후 ivermectin의 상대적 전신 가용성. Eur J 클린 팜. 1988;35:681-4.
11.버레스트 L, 도로 TPC. 방치 된 열대 질병의 치료를 최적화하기 위한 임상 약동 연구의 부족 : 체계적인 검토. 클린 파마코키넷. 2017;56:583–606.
12.Klotz U, 오그부오키리 JE, 오콘코 포. Ivermectin은 플라즈마 단백질에 열렬하게 결합합니다. Eur J 클린 제약콜 1990;39:607-8. https://doi.org/10.1007/BF00316107.
13.우 MA, 포살리 T, 외. COVID-19의 저부안증: 근본적인 폐 모세관 누출에 대한 가설을 평가합니다. J 인턴 메드 2021. https://doi.org/10.1111/joim.13208.
14.세계 보건 기구. 필수 의약품의 WHO 모델 목록에 ivermectin의 포함을위한 응용 프로그램 (EML) 어린이를위한 필수 의약품의 모델 목록 (EMLc). 세계 보건 기구; 2016.
15.마틴 RJ, 로버트슨 AP, 추드하리 S. 이베르멕틴: 안충제, 살충제 등. 트렌드 패러시톨. 2021;37:48–64. https://doi.org/10.1016/j.pt.2020.10.005.
16.챈들러 RE. ivermectin-do 그(것)들은 온초체증의 표시를 넘어 생기는 후에 심각한 신경학상 불리한 사건? Am J 트롭 메드 하이그. 2018;98:382–8. https://doi.org/10.4269/ajtmh.17-0042.
17.왕Q, 장Y, 우 L, 니우 S, 송 C, 장 Z, 외. 인간 ACE2를 사용하여 SARS-CoV-2 항목의 구조적 및 기능적 기초. 세포. 2020. https://doi.org/10.1016/j.cell.2020.03.045.
18.우 A, 펑 Y, 황 B, 외. 중국에서 유래된 새로운 코로나바이러스(2019-nCoV)의 게놈 조성 및 발산. 세포 호스트 미생물. 2020. https://doi.org/10.1016/j.chom.2020.02.001..
19.밀레흐 AM, 킬리안스키 A, 바에즈 산토스 YM, 메세카 AD, 베이커 SC. MERS-CoV 파파인 프로테아즈는 디이스가이클링과 듀비퀴티티활동을 하고 있다. 바이러스학. 2014;450–451:64–70.
20.Lehigh.edu. 바이오스 353. Lehigh.edu; 2021. https://www.lehigh.edu/~jas0/V14.html.
21.Lehrer S, Rheinstein PH. Ivermectin 는 ACE2에 부착된 SARS-CoV-2 스파이크 수용체 결합 도메인에 부두를 부적입니다. 비보에서. 2020;34:3023–6. https://doi.org/10.21873/invivo.12134.
22.에와스 AF, 알호사리 AA, 압델 모네임 AS. 분자 도킹은 SARS-CoV-2에 대한 잠재적 용도 변경 약물로 ivermectin및 remdesivir를 밝혀. 전면 미생물. 2021;11:592908. https://doi.org/10.3389/fmicb.2020.592908.
23.Choudhury A, 다스 NC, 파트라 R, Bhattacharya M, 고쉬 P, 파트라 BC, 외. SARS-CoV-2 병증의 주요 단백질에 대하여 ivermectin의 결합 효험을 탐구합니다: 실리코 접근에. 미래의 비롤. 2021. https://doi.org/10.2217/fvl-2020-0342.
24.풀처 A, 얀스 DA. 바이러스 성 단백질의 뉴클레오세포 플라즈마 인신 매매의 조절; 병인발생에 필수적인 역할? 바이오켐 바이오피스 액타 몰 셀 Res. 2011;1813:2176-90.
25.양SNY, 앳킨슨 SC, 왕 C, 리 A, 보고예비치 MA, 보그 NA, 외. 광스펙트럼 항바이러스 아이버멕틴은 호스트 핵 수송 수입α/β1 이종수계를 표적으로 한다. Antivir Res. 2020;177:104760.
26.프리드먼 JC. 제 4장― 평면 지질 이중층의 이오노포레스. 에서: 스페렐라키스 N, 편집자. 세포 생리학 소스북. 막 생물 물리학의 필수, 4 ed. 런던, 영국; 월섬, 미국, 미국; 샌디에이고, 캘리포니아, 미국: 학술 언론; 2012. p. 61-6.
27.Rizzo E. Ivermectin, 항 바이러스 특성 및 COVID-19: 행동의 가능한 새로운 메커니즘. Naunyn Schmiedebergs 아치 Pharm. 2020;393:1153-6. https://doi.org/10.1007/s00210-020-01902-5.
28.듀냐스 곤잘레스 A, 후아레스-로드리게스 M. 이베르멕틴: 새로운 항암으로 다재다능한 항기생충의 잠재적 재변. 에: 레이몬드 C, 달글리쉬 A, 편집자. 암에 대 한 용도 변경 된 약물. 인테크오픈; 2021. https://doi.org/10.5772/intechopen.99813.
29.도밍게즈 고메즈 G, 차베스 블랑코 A, 메디나 프랑코 JL, 살디바 곤잘레스 F, 플로레스-토론테기 Y, 후아레스 M, 외. 암 줄기 같은 세포의 억제제로 Ivermectin. 몰 메드 의원 2018;17:3397-403. https://doi.org/10.3892/mmr.2017.8231.
30.Heidary F, 가레바기 R. Ivermectin: COVID-19 보완 요법에 항 바이러스 효과에서 체계적인 검토. J 안티비오트. 2020;73:593–602. https://doi.org/10.1038/s41429-020-0336-z.
31.와그스태프 KM, 롤린슨 SM, 허프스 AC, 얀스 DA. 알파스크린(R) 기반 분석체는 핵 수입의 특정 억제제에 대한 고처리량 스크리닝을 위한 것입니다. J 바이오몰 스크린. 2011;16:192–200. https://doi.org/10.1177/1087057110390360.
CAS Article PubMed Google Scholar
32.Bennett SM, Zhao L, Bosard C, Imperiale MJ. Role of a nuclear localization signal on the minor capsid proteins VP2 and VP3 in BKPyV nuclear entry. Virology. 2015;474:110–6. https://doi.org/10.1016/j.virol.2014.10.013.
CAS Article PubMed Google Scholar
33.Raza S, Shahin F, Zhai W, et al. Ivermectin inhibits bovine herpesvirus 1 DNA polymerase nuclear import and interferes with viral replication. Microorganisms. 2020;8. https://doi.org/10.3390/microorganisms8030409.
34.Caly L, Druce JD, Catton MG, Jans DA, Wagstaff KM. The FDA-approved drug ivermectin inhibits the replication of SARS-CoV-2 in vitro. Antiviral Res. 2020;104787. https://doi.org/10.1016/j.antiviral.2020.104787.
35.Arshad U, Pertinez H, Box H, et al. Prioritization of anti-SARS-Cov-2 drug repurposing opportunities based on plasma and target site concentrations derived from their established human pharmacokinetics. Clin Pharmacol Ther. 2020. https://doi.org/10.1002/cpt.1909.
36.Yagisawa M, Foster PJ, Hanaki H, Ōmura S. Global trends in clinical studies of ivermectin in COVID-19. Jpn J Antibiotics. 2021;44:74-1.
37.Swargiary A. Ivermectin as a promising RNA-dependent RNA polymerase inhibitor and a therapeutic drug against SARS-CoV2: evidence from in silico studies. Research Square; 2020. https://doi.org/10.21203/rs.3.rs-73308/v1.
38.V’kovski P, Kratzel A, Steiner S, et al. Coronavirus biology and replication: implications for SARS-CoV-2. Nat Rev Microbiol. 2021;19:155–70. https://doi.org/10.1038/s41579-020-00468-6.
39.Ma Y, Wu L, Shaw N, Gao Y, Wang J, Sun Y, et al. Structural basis and functional analysis of the SARS coronavirus nsp14-nsp10 complex. Proc Natl Acad Sci USA. 2015;112:9436–41.
40.Mody V, Ho J, Wills S, Mawri A, Lawson L, Ebert MCCJC, et al. Identification of 3-chymotrypsin like protease (3CLPro) inhibitors as potential anti-SARS-CoV-2 agents. Commun Biol. 2021;4:93. https://doi.org/10.1038/s42003-020-01577-x.
CAS Article PubMed PubMed Central Google Scholar
41.Sekimoto T, Imamoto N, Nakajima K, Hirano T, Yoneda Y. Extracellular signal-dependent nuclear import of Stat1 is mediated by nuclear pore-targeting complex formation with NPI-1, but not Rch1. EMBO J. 1997;16:7067–77.
42.Konno Y, Kimura I, Uriu K, Fukushi M, Irie T, Koyanagi Y, et al. SARS-CoV-2 ORF3b is a potent interferon antagonist whose activity is further increased by a naturally occurring elongation variant. Cell Rep. 2020. https://doi.org/10.1016/j.celrep.2020.108185.
43.Yang D, Chu H, Hou Y, Chai Y, Shuai H, Lee AC-Y, et al. Attenuated interferon and pro-inflammatory response in SARSCoV-2-infected human dendritic cells is associated with viral antagonism of STAT1 phosphorylation. J Infect Dis. 2020. https://doi.org/10.1093/infdis/jiaa356.
44.Matsuyama T, Kubli SP, Yoshinaga SK, et al. An aberrant STAT pathway is central to COVID-19. Cell Death Differ. 2020;27:3209–25. https://doi.org/10.1038/s41418-020-00633-7.
CAS Article PubMed Google Scholar
45.Seth C, Mas C, Conod A, Mueller J, Siems K, Kuciak M, et al. LongLasting WNT-TCF response blocking and epigenetic modifying activities of withanolide f in human cancer cells. PLoS ONE. 2016;11:e0168170.
46.Park A, Iwasaki A, Type I. and type III interferons—induction, signaling, evasion, and application to combat COVID-19. Cell Host Microbe. 2020;27:870–8.
47.Zhang X, Song Y, Ci X, et al. Ivermectin inhibits LPS-induced production of inflammatory cytokines and improves LPS-induced survival in mice. Inflamm Res. 2008;57:524–9. https://doi.org/10.1007/s00011-008-8007-8.
CAS Article PubMed Google Scholar
48.Liu T, Zhang L, Joo D, Sun S-C. NF-κB signaling in inflammation. Signal Transduct Target Ther. 2017;2:17023 https://doi.org/10.1038/sigtrans.2017.23.
Article PubMed PubMed Central Google Scholar
49.Jiang L, Wang P, Sun YJ, Wu YJ. Ivermectin reverses the drug resistance in cancer cells through EGFR/ERK/Akt/NF-κB pathway. J Exp Clin Cancer Res. 2019;38:265 https://doi.org/10.1186/s13046-019-1251-7.
CAS Article PubMed PubMed Central Google Scholar
50.Zheng S, Fan J, Yu F, Feng B, Lou B, Zou Q, et al. Viral load dynamics and disease severity in patients infected with SARSCoV-2 in Zhejiang province, China, January-March 2020: retrospective cohort study. BMJ. 2020;369:m1443.
51.Ackermann M, Verleden SE, Kuehnel M, Haverich A, Welte T, Laenger F, et al. Pulmonary vascular endothelialitis, thrombosis, and angiogenesis in Covid-19. N Engl J Med. 2020. https://doi.org/10.1056/NEJMoa2015432.
52.Zheng Z, Peng F, Xu B, Zhao J, Liu H, Peng J, et al. Risk factors of critical & mortal COVID-19 cases: a systematic literature review and meta-analysis. J Infect. 2020. https://doi.org/10.1016/j.jinf.2020.04.021.
53.Diao B, Wang C, Tan Y, Chen X, Liu Y, Ning L, et al. Reduction and functional exhaustion of T cells in patients with coronavirus disease 2019 (COVID-19). Front Immunol. 2020;11:827.
54.Hadjadj J, Yatim N, Barnabei L, Corneau A, Boussier J, Smith N, et al. Impaired type I interferon activity and inflammatory responses in severe COVID-19 patients. Science. 2020;369:718–24.
55.Chen W, Zheng KI, Liu S, Yan Z, Xu C, Qiao Z. Plasma CRP level is positively associated with the severity of COVID-19. Ann Clin Microbiol Antimicrob. 2020;19:18.
56.Bharadwaj U, Kasembeli MM, Robinson P, Tweardy DJ. Targeting janus kinases and signal transducer and activator of transcription 3 to treat inflammation, fibrosis, and cancer: rationale, progress, and caution. Pharm Rev. 2020;72:486–526.
57.Frieman M, Yount B, Heise M, Kopecky-Bromberg SA, Palese P, Baric RS. Severe acute respiratory syndrome coronavirus ORF6 antagonizes STAT1 function by sequestering nuclear import factors on the rough endoplasmic reticulum/golgi membrane. J Virol. 2007;81:9812–24.
58.Kim J-H, Choi HS, Kim S-L, Lee D-S. The PAK1-Stat3 signaling pathway activates IL-6 gene transcription and human breast cancer stem cell formation. Cancers. 2019;11:1527.
59.Dou Q, Chen H-N, Wang K, Yuan K, Lei Y, Li K, et al. Ivermectin induces cytostatic autophagy by blocking the PAK1/Akt axis in breast cancer. Cancer Res. 2016;76:4457–69.
60.De Melo GD, Lazarini F, Larrous F, et al. Attenuation of clinical and immunological outcomes during SARS-CoV-2 infection by ivermectin. EMBO Mol Med. 2021;13:e14122. https://doi.org/10.15252/emmm.202114122.
Article PubMed PubMed Central Google Scholar
61.Priel A, Silberberg SD. Mechanism of ivermectin facilitation of human P2X4 receptor channels. J Gen Physiol. 2004;123:281–93. https://doi.org/10.1085/jgp.200308986.
CAS Article PubMed PubMed Central Google Scholar
62.Stokes L, Layhadi JA, Bibic L, Dhuna K, Fountain SJ. P2X4 receptor function in the nervous system and current breakthroughs in pharmacology. Front Pharm. 2017;8:291. https://doi.org/10.3389/fphar.2017.00291.
63.Layhadi JA, Turner J, Crossman D, Fountain SJ. ATP evokes Ca2+ responses and CXCL5 secretion via P2X4 receptor activation in human monocyte-derived macrophages. J Immunol. 2018;200:1159. https://doi.org/10.4049/jimmunol.1700965.
CAS Article PubMed Google Scholar
64.Andersson U, Ottestad W, Tracey KJ. Extracellular HMGB1: a therapeutic target in severe pulmonary inflammation including COVID-19? Mol Med. 2020;26:42. https://doi.org/10.1186/s10020-020-00172-4pmid.
65.Juarez M, Schcolnik-Cabrera A, Dueñas-Gonzalez A. The multitargeted drug ivermectin: from an antiparasitic agent to a repositioned cancer drug. Am J Cancer Res. 2018;8:317–31.
CAS PubMed PubMed Central Google Scholar
66.Xydakis MS, Dehgani-Mobaraki P, Holbrook EH, et al. Smell and taste dysfunction in patients with COVID-19. Lancet Infect Dis. 2020;20:1015–6. https://doi.org/10.1016/S1473-3099(20)30293-0.
CAS Article PubMed PubMed Central Google Scholar
67.Ci X, Li H, Yu Q. Avermectin exerts anti-inflammatory effect by downregulating the nuclear transcription factor kappa-B and mitogen-activated protein kinase activation pathway. Fundam Clin Pharm. 2009;23:449–55.
68.Yan S, Ci X, Chen N. 알레르기 성 천식의 마우스 모델에서 ivermectin의 항 염증 효과. 인플램 Res. 2011;60:589-96.
69.자이디 AK, 다우디 S, 피로 M, 몬티 M, 모바라키 PD. COVID-19 병리학, 임상 프리젠 테이션 및 결과에서 부속 A2 및 플라스민의 핵심 역할 - 검토. 이탈 J 프레브, 디아그네 테어 메드 2020;3. https://doi.org/10.30459/2020-24.
70.스하임 데. COVID-19 치료를 위한 Ivermectin: CD147 중재혈관 폐색의 가설완화를 통해 준 임계 값 복용량에서 임상 반응 (6 월 26, 2020). SSRN에서 사용할 수: https://ssrn.com/abstract=3636557.
71.정Y, 마 YT, 장 JY, 외. COVID-19 및 심장 혈관 시스템. 낫 레브 카디오블. 2020;17:259–60. https://doi.org/10.1038/s41569-020-0360-5.
72.나가이 H, 사토미 T, 아비루 A, 미야모토 K, 나가사와 K, 마루야마 M, 외. 저산소증 하에서 미토콘드리아 ATP 수준을 유지하는 작은 분자의 항중위축 효과. EBioMedicine. 2017;24:147–58. https://doi.org/10.1016/j.ebiom.2017.09.022.
토론
Ivermectin, 오랜 시간 동안 항 기생충 약물으로, 주요 메커니즘은 글루타민트와 무척추 동물 (낮은 개발 된 동물)을 중단 글루타민산과 γ -aminobutyric 산의 염화물 의존 채널을 대상으로했기 때문에 고도로 발달 된 동물에서 매우 안전한 것으로 입증되었다. 인간에서는 중추 신경계를 잘 보호할 수 있는 혈액-뇌 장벽이 존재합니다(Develoux, 2004). Ivermectin거의 약물 저항을 자극, 부작용의 대부분은 항원의 방출과 관련이 있었다, 하지 ivermectin 자체 (부신에q, 2005). ivermectin의 좋은 내성은 심지어 어린이 또는 유아에서 표시되었다. 총 170명의 유아와 어린이(체중 < 15kg)가 경구 이버멕틴으로 치료되었으며, 7명의 피험자만이 경미한 부작용이 보고되었지만 매우 심각하지는 않은 것으로 보고되었습니다(Levy et al., 2020). 임산부의 ivermectin 노출 후 심각한 사건 (사산, 자발적 낙태, 신생아 사망 및 선천성 이상)에 대한 기존 증거를 평가했을 때 임신 을 한 893 명의 여성은 저출산 체중, 신생아 사망, 조산 또는 모성 이환율을보고하지 않았으며, 이는 ivermectin의 높은 안전성을 나타내지 만 여전히 임신 중 의 특정 안전성을 결론짓기에는 증거가 부족했습니다 .ivermectin의 특정 안전성을 결론짓기에는 여전히 부족했습니다. 2020).항기생충 약물 ivermectin에 대한 약동학의 연구는 다른 질병에 사용되는 ivermectin에 도움이 될 몇 가지 기준 값을 제공했다. 피험자(n =68)는 현재 인간의 사용을 위해 승인된 것보다 더 높거나 더 빈번한 용량으로 치료되었다(FDA 승인 ivermectin 투여량 200 μg/kg). 그 결과 ivermectin은 일반적으로 FDA 승인 용량(2000 μg/kg)의 10배에서도 일반적으로 잘 용인되었으며 CNS 독성과 관련된 경우는 거의 나타나지 않았습니다. 또한, 곡선 비율 의 평균 영역은 1.24 및 1.40 30 및 60 mg 용량에 대해 각각, 이는 ivermectin의 축적이 최소화된 것으로 나타났다 (Guzzo et al., 2002). ivermectin로 치료 하는 환자의 큰 숫자는 안전 하 고 잘 용납 약물 표시. 그것은 ivermectin 임상 응용 프로그램에서 큰 가치에 설정 하는 가능성이 더 높았다.
Ivermectin 항 바이러스 에이전트의 미래 개발에 대 한 기초 로 보였다, 그리고 많은 연구는 ivermectin의 광범위 한 항 바이러스 활성으로 보고 되었습니다. 예를 들어, ivermectin은 바이러스 성 단백질 발현의 다운규제뿐만 아니라, 바이러스 전염성 주기(Varghese et al., 2016)의감소된 합성을 일으켰다. Ivermectin은 핵 수송 억제 특성을 가지고 있으며 높은 처리량 화면을 통해 수입 α / β 핵 수입의 광범위한 스펙트럼 억제제로 입증되었습니다. 또한, 아이버멕틴은 HIV-1 및 뎅기열 바이러스의 복제를 억제할 수 있었다(Wagstaff et al., 2012). 한 연구는 또한 ivermectin 치료 복용량 의존 방식으로 바이러스 DNA 합성 및 자손 바이러스 생산을 방해 하 여 의사 바이러스 감염을 억제 하는 입증. 이 과정에서 UL42의 핵 국산화는 핵 국소화 신호 경로를 대상으로 하여 ivermectin에 의해 영향을 받았다(Lv et al., 2018). 본 연구에서, KEGG 통로 분석은 HCMV, HPV, EBV 및 HIV1 감염 통로를 포함하여 4개의 바이러스 관련 통로를 보여주었습니다. 그 4개의 ivermectin 통제된 바이러스 관련 통로는 완전히 362개의 단백질을 포함했습니다. 이 단백질의 다수는 바이러스 감염의 결과와 밀접하게 연관되었습니다. NFKB는 자외선 조사, 산화 자유 라디칼, 사이토카인 및 세균 또는 바이러스 성 제품과 같은 다양한 세포 외 자극에 의해 활성화되는 전사 레귤레이터입니다. 헤르페스 심플렉스 바이러스 ICP0 단백질, 바이러스 E3 유비퀴틴 리간아제, 크게 억제 종양 괴사 인자-α (TNF-α)-매개 핵 인자 θB (NF-θB) NF-θB의 p65 및 p50 서브 유닛으로 결합하여 활성화, 이는 헤르페스 심플렉스 바이러스의 병기 및 면역 회피에 기여할 수있다 (J 장, 왕, 왕, 21). DDX58은 RNA 헬리케이스-DEAD 박스 단백질 모티프및 카스파스 모집 도메인을 함유한 단백질을 인코딩했습니다. 그것은 면역 반응과 이중 좌초 RNA 인식의 바이러스 성 조절에 관여. 또한, DDX58은 면역 병리학 변경(Rehwinkel & Gack, 2020)으로이어지는 다른 숙주 유래 유전자 및 유형 I 인터페론의 전사 유도를 중재하였다. EIF2AK2는 dsRNA에 결합한 후 자가포스포릴화에 의해 활성화되는 세린/스레오닌 단백질 키나아제인코딩. 인코딩된 단백질의 활성화된 형태는 번역 개시인 EIF2S1을 인광할 수 있으며, 이는 단백질 합성을 억제한다. EIF2AK2는 타입 I 인터페론 자극 유전자의 하나로서, 중요한 생물학 및 면역 기능을 보여주었습니다. 바이러스 감염에서, EIF2AK2 억제 또는 촉진 바이러스 복제 (Wei 등. 2020). HCMV 감염 통로의 관점에서, 총 85 ivermectin 관련 단백질이 확인되었습니다. 그들 중 일부는 이전 연구에서 ivermectin에 의해 중재 보고 되었습니다. 예를 들어, ivermectin은 미토콘드리아 칼슘 이온 과부하, 미토콘드리아 막 잠재력 및 반응성 산소 종 생성의 손실을 통해 상피 세포의 세포 멸망을 유도하였다. 기계론적 접근법으로서, Ivermectin은 AKT, PI3K 및 MAPK 통로(Lee et al., 2019)를포함한 세포 신호 경로를 조절하였다. Ivermectin는 또한 세포 성장을 억제하기 위해 CCND1 및 CDK4의 다운 규제를 통해 G1 단계에서 세포 주기 체포를 조절 (Diao et al., 2019). HPV 감염 통로의 관점에서, 총 107 ivermectin 관련 단백질이 확인되었습니다. 확인 된 관련 단백질 중 일부는 이전 연구에서 ivermectin에 의해 중재 되었습니다. 예를 들어, ivermectin은 BCL-2 발현의 하향 조절에 의해 자멸을 유도하고, BAX 발현의 강화 조절, 갈라진 폴리 [ADP-ribose] 폴리머라제 및 CASP3 활성(덩, 쉬, 롱, 및 Xie, 2018).. Ivermectin은 EGFR의 세포외 도메인과 결합하여 EgFR 및 다운스트림 신호의 활성화를 억제함으로써 P-glycoprotein의 전사를 감소시켰으며, P-glycoprotein 활성(Jiang, Wang, Sun, & Wu, 2019)을직접 억제하는 것이 아닙니다. EBV 감염 통로의 관점에서, 총 79 ivermectin 관련 단백질이 확인되었습니다. 그들 중 일부는 이전 연구에서 ivermectin에 의해 중재 보고 되었습니다. 예를 들어, ivermectin은 LPS(X. Zhang et al., 2009)로세포를 자극한 후 미토겐 활성화 단백질 키나아제(MAPK8)의 인산화를 억제함으로써 산화질소 신디하제 및 사이클로산소아제-2 효소를 억제하는 것으로 입증되었다. Ivermectin은 ivermectin이 특정 후생유전학 탈제제 SIN3A (후아레즈, 슈콜닉 카브레라, 및 Dueñas-Gonzalez, 2018)를포함하여 다표적과 상호 작용하기 때문에 재배치된 항균제, 항바이러스 및 항암제에 대한 항기생충제에서 일 수 있습니다. HIV1 감염 경로의 관점에서, 총 91 ivermectin 관련 단백질확인 되었습니다. 그들 중 일부는 이전 연구에서 ivermectin에 의해 중재 보고 되었습니다. 예를 들어, ivermectin-유도 된 자가phagy는 유비퀴티닌 중재 저하 경로를 통해 감소 된 P21 활성화 키나아제 1 (PAK1) 발현과 연관되었다 (Dou et al., 2016).
SARS-CoV-2의 발병 과 전염병으로 인해 전 세계는이 공중 보건 비상 사태에 대해 우려하고 있습니다. 역학 연구는 SARS-CoV-2가 빠른 전송을 했다는 것을 보여주었고, 예방 조치가 취해지지 않을 때 각 감염이 1.4에서 3.9의 새로운 감염귀착될 수 있다는 것을 추정했습니다 (Benvenuto et al., 2020). 바이러스는 주로 가까운 접촉 또는 호흡 물방울을 통해 퍼집니다. 많은 연구자들은 SARS-CoV-2가 인간 세포(Letko, Marzi, & Munster, 2020)를입력하기 위해 수용체 안지오텐신 변환 효소 2(ACE2)에 결합할 수 있음을 입증했습니다. Ivermectin, FDA 승인 된 항 기생충 약물, SARS-CoV-2의 억제제로 최근 연구에서 여러 번 보고 되었다 (칼리 등., 2020). 이버멕틴은 수입(IMPα/β1)을 억제하고 산성 환경을 조성하여 바이러스 성 수입을 중재하였다(Caly et al., 2020). Caly et al.은 ivermectin 치료 그룹(5 μM ivermectin)과 SARS-CoV-2 RNA 수준에서 대조군 사이의 5000배 감소를 보고했다. The IC50 SARS-CoV-2용 아이버멕틴은 약 2.5μM로 계산되었다. 건강한 자원 봉사자에 이전 약동 연구에 따르면, 그것은 제안 한 단일 복용량 120 ivermectin의 mg 안전 하 고 잘 용납 입증 (차쿠르, 함만, 라몬 가르시아, 그리고 라비노비치, 2020). 최근 연구에서, 정량적 트랜스원자및 SILAC 계 프로테오믹스는 글리코리시스, 번역, 접합, 프로테오스타시스 및 뉴클레오티드 합성(Bojkova et al., 2020)을포함하는 인간 결장 상피 암종 세포주에서 SARS-CoV-2 감염에 대한 세포 반응의 신호 경로 프로파일을 확인했습니다. 이 연구에서는, SILAC는 인간 난소암 세포주 TOV-21G를 분석하기 위하여 이용되었습니다. 10개의 통로 후에, TOV-21G 세포는 24 시간 동안 20 μmol/L ivermectin에 의해 처리되었습니다. 흥미롭게도, GencLip3(n = 284)에서 보고된 SARS-CoV-2/COVID-19 관련 유전자와 비교하여, 우리는 ivermectin의 유무에 관계없이 치료할 때 52개의 SARS-CoV-2/COVID-19 관련 단백질 변경을 확인했습니다. 예를 들어, CD147(BSG)-인코딩된 단백질은 또한 면역글로불린 슈퍼패밀리의 일원인, 그리고 보고된 가능한 직접 바이러스 침입/줄기 세포의 CD147(BSG; 울리히 & 필라트, 2020). RB1은 세포 주기의 부정적인 조절자였으며 발견된 최초의 종양 억제유전자였다. SARS-CoV-1의 구조적 상동성은 SARS-CoV-2가 pRb를 직접 손상시킬 수 있음을 나타냅니다. SARS-CoV-2에 의한 탁월한 염증 반응 및 강한 산화 스트레스를 고려할 때 SARS-CoV-2가 높은 발암 성 위험과 관련이 있는지 여부는 오랜 기간 동안 지켜봐야합니다 (알팔하오, 페레이라 및 필리핀, 2020). 염증성 사이토카인의 높은 수준의 발현은 IL-1β, MCP-1, IL-6, TNF-α 및 TGF-β1(He et al., 2006)을포함한 SARS-CoV 감염 환자에서 급성 폐 손상 및 병인과 밀접한 관련이 있었다. 우리의 데이터는 또한 TNFB1, IL18 및 IL1F10과 같은 SARS-CoV-2 유도 사이토카인 폭풍에서 ivermectin-규제 키 인터류킨을 확인했습니다. Ivermectin 잠재적으로 새로운 코로나 바이러스 감염에 대 한 행동 하는 것 같았다. 우리는 SARS-CoV-2 감염의 처리에 사용된 ivermectin의 기계장치를 제공했습니다.
임산부
불확실성
현재 여성은 마지막 생리 기간에 따라 임신하는 경우 ivermectin을 하지 말라고 합니다. 그러나, 많은 여자는 임신하고 MDA 프로그램에 있는 임산부의 대략 15%가 실수로 ivermectin를, 그들의 첫번째 삼보격에, 모르지 않을 지도 모릅니다.랜싯 글로벌 헬스에서패트리샤 니콜라스와 동료들은 첫 번째 체계적인 검토 및 메타 분석을 수행했습니다.그것은 임신 도중 ivermectin의 의도하지 않은 섭취가 이상한 출생 결과에 결과 초래하는지 여부를 해결하기 위하여 디자인된 6개의 간행된 연구 결과에 집중합니다. 6개의 연구 결과의 5개는 나중에 ivermectin를 취한 것을 것을을 발견한 여자 사이 이상한 출생 결과 (사산, 자발적인 낙태 및 선천적인 이상)를 비교하는 MDA 프로그램의 40 주 안에 전달한 여자의 회고사례 통제 연구 결과이었습니다. 6개의 연구 결과 의 한개는 두 번째 삼보격에 있는 ivermectin를 수신한 임산부의 무작위 통제 된 시험이었습니다.전반적으로, 니콜라스와 동료의 체계적인 검토 및 메타 분석은 임신 도중 ivermectin를 수신한 여자에 있는 과잉 이상한 출생 결과에 대한 증거를 보여주는 아무 연구 도 확인했습니다. 그(것)들은 그 때 무작위예심을 위한 편견 공구의 엄격한 코크레인 리스크를 적용하고 기록의 아주 낮은 확실성을 가지고 있는 모든 연구 결과를 분류했습니다. 결과적으로, 그들은 현재의 증거가 ivermectin이 임신 도중 안전하다는 것을 지원하지 않으며 MDA 프로그램 도중 처리에서 임산부를 계속 제외하는 것을 추천한다는 것을 결론을 내렸습니다. 이 결론은 이러한 연구에서 노출 된 여성의 누적 수를 고려하면 안전한 평가입니다(전체 899 노출 대 3104 노출되지 않음), 그러나 어려운 상황에서 잘 수행 된 연구를 다운 그레이드합니다. 이 연구 결과에서는, 가난한 출생 결과는 희소하지 않았습니다; 총 47개의 선천성 이상과 177개의 사산 또는 자발적인 낙태가 확인되었기 때문에 연구가 저조했다고 말하기는 어렵습니다. 그러나 임신에 있는 ivermectin의 안전한 사용이 MDA 프로그램에 중요한 진보가 될 것이기 때문에 더 많은 연구 결과가 필요합니다.
안전한 복용량
나는 많은 사람들이 예방 사용법과 복용량을 찾고 있음을 알았습니다.나는 몇 가지 수집 작업을 수행했으며 몇 가지 참조를 제공하기를 바랍니다.
아연
실용적인 목적을 위해, 아연 이온의 혈청 수준은 적절한 수준으로 올라가야합니다. 아연에 대 한 정상적인 매일 식이 요구 사항은 약 7 mg.성인은 실제로 하루에 15mg이 필요합니다. Zn++ 이온으로 보충 아연은 COVID-19 바이러스에 대한 예방 목적을 위해 여러 번이어야한다. 아연은 매일 약 100-300 mg의 섭취량에 독성이 있으며 매일 2,000 mg에 접근하는 용량에서 치명적입니다.
비타민C
하루 1000mg은 안전합니다.하루 20,000mg 이상은 메스꺼움과 설사를 유발할 수 있습니다.
비타민D
매일 5000IU를 복용하면 질병 후 사망률을 효과적으로 줄일 수 있습니다.하루에 50,000IU 이상을 복용하면 고칼슘혈증 반응을 일으킬 수 있습니다.10,000IU 미만은 안전한 것으로 간주됩니다.
퀘르세틴
하루 500mg은 안전한 것으로 간주됩니다.하루 1000mg은 18주 후에 불확실합니다.
EGCG
하루 200~400mg은 안전한 것으로 간주됩니다.400mg 이상에서는 불확실성이 있습니다.
이버멕틴
이버멕틴 (5세 미만이거나 체중이 15kg(33파운드) 미만인 어린이 와 간 또는 신장 질환이 있는 환자의 경우 정맥 호르몬 투여가 금기입니다. 모유 내 약물의 농도는 매우 낮습니다. (이버멕틴이 임신 중에 안전한지 여부는 불분명합니다) 15~24kg은 반정(약 3mg), 25~34kg은 1정(약 6mg), 35~50kg은 1.5정(약 9mg)이다. 51- 65kg의 경우 2정(약 12mg), 66-79kg의 경우 2.5정(약 15mg), 80kg 이상의 경우, 15mg입니다.
(일주일에 12mg을 섭취하면 7일 후에 93%가 몸에서 배설됩니다.식후에 복용하면 효과가 더 좋습니다.고단백 고지방 음식은 흡수를 돕습니다.)
하이드록시클로로퀸
하이드록시클로로퀸 (4-아미노린 화합물에 알레르기가 있는 것으로 알려진 사람들은 하이드록시클로로퀸을 처방해서는 안 됩니다. 치료를 받고 있는 사람은 특정 심장병, 당뇨병 또는 건선이 있으므로 주의해야 합니다.) 6세 미만의 소아는 금기이며 200mg정은 체중 35kg 미만의 소아에게는 적합하지 않습니다.
(반감기는 약 30일입니다.)
예방 효과
이버멕틴>하이드록시클로로퀸>퀘르세틴>EGCG
퀘르세틴가장 안전합니다.
예방 방법을 참조하십시오.새로운 바이러스는 전염성이 매우 높기 때문에 이버멕틴12mg+하이드록시클로로퀸200mg을 일주일에 한 번 복용하는 것이 좋습니다.(정상적인 건강 상태에서)
백신 부작용 치료를 위한 이버멕틴의 타당성
인간 사이토메갈로바이러스(HCMV), 인간 유두종바이러스(HPV), 엡스타인-바 바이러스(EBV), 인간 면역결핍 바이러스(HIV), 코로나바이러스(중증 급성 호흡기 증후군 코로나바이러스 2[SARS-CoV-2]와 같은 바이러스는 전 세계적으로 인간의 건강에 큰 부담을 나타냅니다. FDA 승인 항 기생충 약물 ivermectin또한 항균제, 항바이러스 및 항암제, 이는 글로벌 공중 보건을 개선하기 위해 더 많은 잠재력을 제공하며, 체외에서 SARS-CoV-2의 복제를 효과적으로 억제할 수 있습니다. 이 연구 결과는 인간 난소 암 세포에 있는 ivermectin 관련 바이러스 감염 통로 변경을 확인하기 위하여 노력했습니다. 세포 배양(SILAC)에서 아미노산에 의한 안정적인 동위원소 라벨링은 난소암 세포에서 4447 ivermectin 관련 단백질을 확인한 24시간 동안 ivermectin(20 μmol/L)의 이버멕틴(20 μmol/L)을 사용하지 않고 치료된 인간 난소암 세포 TOV-21G를 분석하는 데 사용되었습니다. 통로 네트워크 분석은 HCMV, HPV, EBV 및 HIV1 감염 통로를 포함하여 4개의 통계적으로 유의한 항바이러스 통로를 밝혔습니다. 흥미롭게도, GencLip3에서 보고된 284개의 SARS-CoV-2/COVID-19 관련 유전자와 비교하여, 우리는 ivermectin의 유무에 관계없이 취급될 때 52개의 SARS-CoV-2/COVID-19 관련 단백질 변경을 확인했습니다. 단백질-단백질 네트워크(PPI)는 284개의 SARS-CoV-2/COVID-19 관련 유전자와 ivermectin에 의해 조절되는 52개의 SARS-CoV-2/COVID-19 관련 단백질 사이의 상호 작용에 기초하여 생성되었다. PPI 네트워크의 분자 복합 검출 분석은 사이토카인 및 성장 인자 가족, MAP 키나아제 및 G 단백질 제품군 및 HLA 급 단백질을 포함한 3개의 허브 모듈을 확인했습니다. 유전자 종양학 분석은 10 개의 통계적으로 유의한 세포 성분, 13개의 분자 기능 및 11개의 생물학적 과정을 밝혔습니다. 이 사실 인정은 바이러스 관련 질병에 있는 예측, 예방 및 개인화한 약의 맥락에서 COVID-19 처리를 위한 이득ivermectin의 광범위 스펙트럼 항바이러스 속성을 보여줍니다.
이버멕틴은 이 스파어크 단백질을 죽입니다
일본과 인도에 의해 Covid-19를 취급하기 위하여 ivermectin의 최근 신청은 이 두 나라에 있는 긍정적인 케이스 및 입원한 환자 둘 다의 수를 현저하게 아래로 가져왔습니다. 그러나, 이러한 기적으로 이어지는 ivermectin의 분자 메커니즘은 아직 완전히 이해 되지 않습니다. 이 문서는 ivermectin의 잠재적인 기계장치에 대한 실리코 (계산) 연구에서 최근 요약하고이 '경이로운 약물'SARS-Cov-2의 전체 감염 주기동안 여러 가지 중요한 단백질을 대상으로 할 수 있음을 보여줍니다.
1. 이버멕틴은 SARS-Cov-2를 인간 세포로 유입하는 것을 방해할 수 있습니다.
2. 이베르멕틴은 SARS-Cov-2 복제를 위한 단백질의 생산을 막을 수 있었습니다.
3. 이베르멕틴은 SARS-Cov-2 비구조적 단백질 수송을 핵으로 방해할 수 있습니다.
4. 이베르멕틴은 SARS-Cov-2 비구조적 단백질을 직접 억제할 수 있습니다.
5. 이베르멕틴은 SARS-Cov-2의 구조적 단백질 의 조립을 방해할 수 있습니다.
위의 정보는 이버멕틴이 백신 부작용의 치료에 효과적임을 보여줍니다.
사용법 및 복용량
백신 부작용에 대한 치료법이 적고 완치 사례도 많지 않기 때문이다.내가 수집한 정보는 매우 제한적입니다.다음 방법은 부작용이 없는 것으로 확인되었으며 시도할 수 있습니다.
아연 25~50mg, 하루에한번 7일간
비타민 C 1000mg, 하루에한번 7일간
비타민 D3 5000IU, 하루에한번 7일간
이버멕틴( Ivermectin ) 0.2/kg, 12mg 하루에한번 7일간
후에: NAC 600mg~750mg+아연 25mg 아침에 일어나서 공복에 복용 매일
아연 25mg+비타민C 1000mg+비타민D3 5000IU+케르세틴 500mg 또는 ( or ) EGCG 400mg+아스타잔틴 4mg 식후에 복용 매일 (3주) 이버멕틴은 반감기 때문에 3주간 중단했다. 한 달에 한 번의 치료 과정.
NAC 산화 그래핀은 체내에서 배설될 수 있습니다.하지만 두 달 만에 효과는 미미했다.아스타잔틴 그것은 뇌를 해독하기 위해 혈액 뇌 장벽을 통과할 수 있습니다.
RESTORIIX 중금속의 강력한 해독 기능을 가지고 있습니다.NAC 과아스타잔틴 의 대체품이 될 수 있습니다.

하이드록시클로로퀸을 만드는 방법 ~ 시도할 또 다른 레시피
1.자몽 3개와 레몬 5개(모든 유기농)의 껍질을 사용하십시오.
2.가장 깨끗한 물 2리터를 끓이세요.
3.필링에 넣고 3시간 동안 계속 끓여서 계속 끓입니다(물에 물을 증발시키는 것을 방지하기 위해 냄비에 뚜껑을 두어)
4.제거하고 식히십시오.
5.유리 메이슨 항아리에 붓고 냉장 보관
6.공복에 아침에 매일 2 큰술을 가져 가라.
혜택...
1.면역 체계를 향상
2.혼잡, 호흡, 감기, 독감, 통증, 통증, 박테리아, 바이러스 등을 없애는 데 도움이 됩니다.
3.전반적인 웰빙 느낌에 추가
메모...
이 필링에는 퀴닌이라고 불리는 하이드록시클로로퀸의 천연활성 성분이 포함되어 있습니다. 알칼리성 물을 사용하는 경우 알칼리성 분자가 매우 친절하고 금속 분자가 이를 고수하기 때문에 금속 냄비에 끓이지 마십시오. 그래서 유리 냄비를 사용합니다. 그렇지 않으면 당신에게 사용할 수있는 최고의 깨끗한 물을 사용하고 스테인레스 스틸 냄비에 끓입니다. 알루미늄 조리기구를 사용하지 마십시오.
'Doit' 카테고리의 다른 글
| 2005년 연구에서 하이드록시클로퀸(HCQ)의 항바이러스 효과 입증 - 파우치 (0) | 2022.01.10 |
|---|---|
| [공유]천연 코로나&말라리아 치료제, 피라맥스 원료 아르테미신(개똥쑥) 이야기입니다 (0) | 2022.01.10 |
| 해독의 꽃 (0) | 2022.01.10 |
| 아티초크에 대해서 (0) | 2022.01.06 |
| 아티쵸크 재배법 (0) | 2022.01.06 |

